بررسی علمی تحریک مغناطیسی مغز از راه جمجمه rTMS
تحریک مغناطیسی مغز از راه جمجمه (rTMS) در حقیقت بیانگر آن است که چگونه توسعه تخصص و فناوری می تواند با هم ترکیب شود تا درمان افسردگی را تغییر دهد. این مقاله به شرح تاریخچه این توسعه می پردازد.
تاریخچه rTMS – بیوفیزیک
کشف القای الکترومغناطیسی توسط مایکل فارادی در سال 1831 یک پیشرفت اساسی در فیزیک است که در نهایت TMS را بعد بیش از 150 سال بعد فعال کرد. کار پیشگام در الکترومغناطیس توسط مایکل فارادی و شاگردش جیمز کلرک ماکسول (به طور تصادفی در سال 1831 کشف شد) فیزیکدانان و سپس فیزیولوژیست ها را قادر ساخت تا اثرات الکتروفیزیولوژیکی میدان های مغناطیسی را مطالعه کنند (1، 2).
میدان های مغناطیسی پالسی برای اولین بار در سال 1965 نشان داده شد که باعث ایجاد کشش در عضلات اسکلتی در مدل های حیوانی و انسان می شود (3). دو دهه بعد، اولین دستگاهی که با استفاده از میدان مغناطیسی پالسی فعالیت قشر مغز ایجاد کرد، توسط فیزیکدان پزشکی آنتونی بارکر و تیمش ساخته شد (4). این اولین دستگاه TMS هر 3 ثانیه یک پالس ارسال می کند و نشان می دهد که تحریک قشر حرکتی حرکات بدن طرف مقابل را برمی انگیزد.
در دهههای بعد، پیشرفتها در مهندسی سیمپیچهای TMS، از جمله بهبود پارامترهای پالس، فناوری خنککننده، و پیکربندیهای سیمپیچ دوگانه، کاربرد تحولآفرین این فناوری را در تحقیقات عصبی فیزیولوژیکی و بالینی ممکن میسازد (5).
این پیشرفتهای فنآوری طیف وسیعی از پارامترهای تحریک را برای بررسی، از جمله دوز تحریک، فرکانس، ریتم و هدف به محققان ارائه کرد. TMS مکرر (rTMS) به کانون مداخله درمانی تبدیل شد، زیرا نشان داده شد تحریک مغناطیسی مغز از راه جمجمه rTMS باعث افزایش یا کاهش پایدار در فعالیت قشر کانونی می شود. اینکه تحریک مغناطیسی مغز از راه جمجمه (rTMS) افزایش یا کاهش فعالیت قشر مغز بستگی به پارامترهای پالس خاص مورد استفاده دارد (6). تحریک “فرکانس بالا”، در محدوده 5 هرتز تا 20 هرتز، به طور گسترده ای برای افزایش فعالیت در ناحیه تحریک شده قشر مغز در نظر گرفته شد.
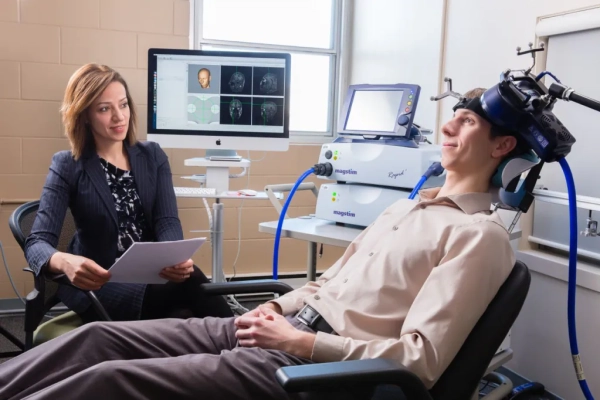
اولین تجربیات بالینی تحریک مغناطیسی مغز از راه جمجمه
از اوایل دهه 1990، بر اساس مطالعات ضایعه مغزی و مطالعات تصویربرداری عصبی عملکردی، اختلال عملکرد قشر جلوی مغزی پشتی جانبی چپ (L-dlPFC) با افسردگی مرتبط بود. به زودی پس از آن، محققان تحریک مغناطیسی مغز از راه جمجمه rTMS بر L-dlPFC به عنوان یک مکان هدف در درمان اختلال افسردگی اساسی (همانطور که در آن زمان توسط DSM-IV تعریف شد) تمرکز کردند (7، 8). این خط از تحقیقات منجر به مطالعه برجسته دوسوکور چند سایتی توسط O’Reardon و همکاران شد. (9) که استخدام در سال 2004 آغاز شد، که در آن بیمارانی که درمان دارویی برای آنها برای اختلال افسردگی اساسی شکست خورده بود، rTMS با فرکانس بالا را بر روی L-dlPFC یا درمان ساختگی دریافت کردند.
rTMS به طور قابل توجهی نرخ پاسخ و بهبودی بیشتری ایجاد کرد. این مطالعه در سال 2007 منتشر شد و در سال بعد، سازمان غذا و داروی آمریکا (FDA) اولین پروتکل rTMS را برای بیمارانی که افسردگی آنها حداقل به یک کارآزمایی کافی از دارودرمانی (10) پاسخ نداده را تأیید کرد: جلسات روزانه درمان rTMS، پنج بار در هفته به مدت 4 تا 6 هفته، با پالس های ارسالی در 10 هرتز، برای مجموع 3000 پالس به L-dlPFC در طول 37.5 دقیقه (9، 11).
تقویت طولانی مدت تحریک مغناطیسی مغز از راه جمجمه rTMS
اگرچه اثربخشی بالینی rTMS نشان داده شده است، مکانیسم دقیقی که توسط آن تحریک مغناطیسی مغز از راه جمجمه rTMS منجر به تغییرات پایدار در فعالیت قشر مغز و تسکین علائم می شود هنوز به طور کامل تعریف نشده است. با این حال، تقویت طولانی مدت (LTP) فعالیت عصبی در مناطق کلیدی مغز مشکوک به ایفای نقش اصلی است (6، 12). LTP به عنوان پایه ای برای بسیاری از اشکال یادگیری و حافظه در نظر گرفته می شود و یکی از مکانیسم های اصلی شکل پذیری سیناپسی است. به طور خلاصه، LTP شامل افزایش کارایی پایدار انتقال سیگنال در سیناپس ها در پاسخ به الگوهای خاص تحریک، مانند اشکال خاص تحریک مغناطیسی مغز از راه جمجمه rTMS است (13).
LTP از طریق تغییرات پیچیده در ماشینهای مولکولی پیش و پس سیناپسی، از جمله گیرندههای سطح سلولی، آزادسازی انتقالدهندههای عصبی، و ساختار سیتوماتیک، واسطه میشود (13). LTP منعکس کننده این اصل است که “سلول هایی که با هم شلیک می کنند، سیم کشی می کنند”، نقل قولی از کتاب رویایی، سازمان رفتار (1949) توسط دونالد هب، به اصطلاح “پدر روانشناسی عصبی”. شواهدی مبنی بر وجود LTP برای اولین بار در اواسط دهه 1960 به تفصیل ارائه شد (14). در همین زمان، روانپزشک برجسته اریک کندل نیز مطالعه مولکولی شکلگیری حافظه، از جمله مطالعه LTP را پیش برد. دکتر کندل به خاطر این کار، جایزه نوبل فیزیولوژی یا پزشکی را در سال 2000 به اشتراک گذاشت.
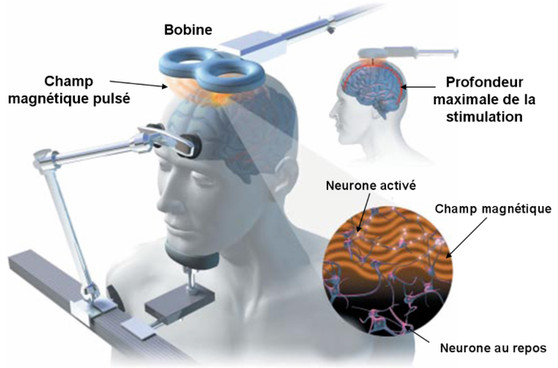
شخصی سازی درمان: دوز و هدف تحریک مغناطیسی مغز از راه جمجمه
تفاوت های فردی در فاصله پوست سر و ساختار سلولی قشر مغز بر پاسخ قشر به TMS تأثیر می گذارد (22). آستانه موتور (MT) به عنوان مفهومی ظاهر شد که اجازه می داد خروجی دستگاه TMS شخصی شود. MT حداقل “دوز” مجزای خروجی دستگاه TMS (به عنوان درصدی از حداکثر خروجی آن) است که برای برانگیختن پاسخ موتور طرف مقابل لازم است. در سال 1998 نشان داده شد که تجسم حرکات دست طرف مقابل به طور موثری به اندازه گیری های الکترومیوگرافی MT نزدیک می شود و این روش را حتی بیشتر ساده می کند (23).
تعیین بصری MT همچنان یک روش پرکاربرد در کلینیکها و تحقیقات TMS است، زیرا امکان تعیین نسبتاً سریع MT را بدون استفاده از ابزارهای تشخیصی اضافی (مانند تشخیص الکترومیوگرافی MT یا EEG بر روی نواحی قشر پیشانی هدف میدهد. ) (24). با این حال، تشخیص این نکته مهم است که استفاده از MT شامل این فرض کلیدی است که آستانه پاسخ سایر نواحی قشر مغز، مانند dlPFC، به اندازه کافی شبیه آستانه پاسخ قشر حرکتی است (24).
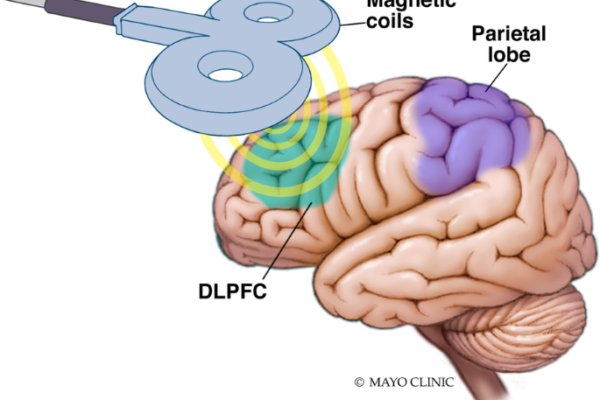
پروتکل مطالعه سال 2007 توسط O’Reardon و همکارانش (9) dlPFC را با استفاده از “قانون 5 سانتی متری” هدف قرار داد، که در آن سیم پیچ 5 سانتی متر جلوتر از محل تحریک قرار می گیرد که باعث ایجاد حرکات حرکتی در انگشت شست راست می شود. با این حال، تا سال 2003، قرار دادن الکترود EEG F3 در سیستم بین المللی 10-20 به عنوان یک روش مطمئن تر برای هدف قرار دادن dlPFC شناسایی شد (25). اکتشافی بیشتر برای موقعیت یابی سیم پیچ و بهبود در این سیستم به دنبال خواهد بود.
همانطور که انتظار می رود، هدف گیری هدایت شده توسط تصویربرداری عصبی پیشنهاد می شود، با پروتکل های تحقیقاتی شامل تکنیک های تصویربرداری ساختاری که به سرعت جای خود را به استفاده از تکنیک های تصویربرداری عملکردی می دهد. در اوایل دهه 2010، مطالعات rTMS شروع به استفاده از MRI اتصال عملکردی (fcMRI) کردند، یک تکنیک تصویربرداری عصبی عملکردی که ارتباط فعالیت بین مناطق مختلف مغز را کمیسازی میکند و امکان نقشهبرداری از شبکههای عصبی را فراهم میکند. مطالعات fcMRI نشان داده است که تحریک ناحیه خاصی از dlPFC که بیشترین ارتباط را با فعالیت در قشر کمربندی قدامی زیرجنسی دارد، منطقه ای که قبلاً به عنوان بیش فعال در افسردگی نقش داشت، ممکن است نرخ پاسخ درمانی را بیشتر بهینه کند (26).
تحولات معاصر و جهت گیری های آینده تحریک مغناطیسی مغز از راه جمجمه
پروتکلهای تسریعشده TMS با پنج تا ده جلسه در یک روز در اوایل سال 2010 موفق بودند (27)، و کارایی سریع بهبود یافته iTBS برنامههای درمانی تسریعشده را تا حد زیادی تسهیل کرد. تا سال 2017، استخدام برای یک کارآزمایی تصادفی دوسوکور تصادفی کنترل شده آغاز شد که یک دوره تسریع شده از 50 جلسه درمانی را تنها در مدت 5 روز با هدف گیری فردی هدایت شده توسط fcMRI ترکیب کرد (28). علاوه بر این، هر یک از جلسات درمانی بهجای 3 دقیقه به مدت 10 دقیقه اجرا شد که در مجموع 90000 پالس در تنها 5 روز تحویل داده شد.
در یک تجزیه و تحلیل موقت برنامه ریزی شده، کارآزمایی به دلیل اثربخشی زودهنگام متوقف شد: 50٪ کاهش علائم و بهبودی به ترتیب در 71٪ و 57٪ از شرکت کنندگان در بازوی درمان حاصل شد، در مقایسه با 13٪ و 0٪ از افراد در گروه کنترل.
اگرچه روند غیر قابل توجهی برای عود علائم در طی 4 هفته پیگیری مشاهده شد، کاهش 50 درصدی علائم و بهبودی به ترتیب در 64 درصد و 43 درصد از افرادی که در بازوی درمان بودند حفظ شد. چنین برنامههای تسریعشده بهویژه برای مطالعات آتی در بسترهای بستری و جایی که درمان سریع افسردگی برای مدیریت حاد خودکشی مورد نیاز است، جذاب است. از سوی دیگر، اکثر کارآزماییها تاکنون بر دوره شاخص درمان متمرکز بودهاند و پیگیریهای محدودی داشتهاند. تحقیق و توسعه آتی نیز احتمالاً به تعیین نقش درمان نگهدارنده تبدیل خواهد شد.
در حالی که درمان تشنجی عموماً برای شدیدترین موارد افسردگی اختصاص داده شده است، دسترسی و اثربخشی در حال ظهور rTMS ممکن است آن را به عنوان مکمل مهمی برای روان درمانی و دارودرمانی در درمان افسردگی قرار دهد. تاریخچه توسعه rTMS تا کنون، از نظریههای بنیادی گرفته تا آخرین پروتکلهای iTBS تسریعشده و شخصیشده (خلاصهشده در شکل 1)، یادآور الهامبخشی است از اینکه چگونه پیشرفتهای بینرشتهای فزاینده میتوانند برای ایجاد جهش در درمان پزشکی گرد هم آیند. این مسیر همچنین بر اهمیت سرمایه گذاری روانپزشکان در سراسر طیف کامل تحقیقات ترجمه، از علوم پایه و توسعه فناوری گرفته تا آزمایشات بالینی و برعکس، تأکید می کند.
1.: Repetitive Transcranial Magnetic Stimulation Treatment for Depressive Disorders. Berlin, Springer, 2013 Crossref, Google Scholar
2.: The body electric: a long view of electrical therapy for functional neurological disorders. Brain 2015; 138:1113–1120 Crossref, Google Scholar
3.: Transcranial Magnetic Stimulation: A Neurochronometrics of Mind. Cambridge, MA, MIT Press, 2003 Google Scholar
4.: Non-invasive magnetic stimulation of human motor cortex. Lancet 1985; 325:1106–1107 Crossref, Google Scholar
5.: The development and modelling of devices and paradigms for transcranial magnetic stimulation. Int Rev Psychiatry 2017; 29:115–145 Crossref, Google Scholar
6.: Basic principles of transcranial magnetic stimulation (TMS) and repetitive TMS (rTMS). Ann Phys Rehabil Med 2015; 58:208–213 Crossref, Google Scholar
7.: Daily repetitive transcranial magnetic stimulation (rTMS) improves mood in depression. Neuroreport 1995; 6:1853–1856 Crossref, Google Scholar
8.: Rapid-rate transcranial magnetic stimulation of left dorsolateral prefrontal cortex in drug-resistant depression. Lancet 1996; 348:233–237 Crossref, Google Scholar
9.: Efficacy and safety of transcranial magnetic stimulation in the acute treatment of major depression: a multisite randomized controlled trial. Biol Psychiatry 2007; 62:1208–1216 Crossref, Google Scholar
10.: A visual and narrative timeline of US FDA milestones for transcranial magnetic stimulation (TMS) devices. Brain Stimul 2022; 15:73–75 Crossref, Google Scholar
11.: FDA approves new option to treat major depression. Psychiatr News 2008; 43:2–17 Crossref, Google Scholar
12.: Possible mechanisms underlying the therapeutic effects of transcranial magnetic stimulation. Front Hum Neurosci 2015; 9:303 Crossref, Google Scholar
13.: Molecular mechanism of hippocampal long-term potentiation: towards multiscale understanding of learning and memory. Neurosci Res 2022; 175:3–15 Crossref, Google Scholar
14.: The discovery of long-term potentiation. Philos Trans R Soc B Biol Sci 2003; 358:617–620 Crossref, Google Scholar
15.: Hans Berger (1873–1941), Richard Caton (1842–1926), and electroencephalography. J Neurol Neurosurg Psychiatry 2003; 74:9 Crossref, Google Scholar
16.: Fundamentals of EEG methodology in concussion research; in Foundations of Sports-Related Brain Injuries. Edited by Slobounov S, W Sebastianelli. Berlin, Springer, 2006 Crossref, Google Scholar
17.: The theta rhythm of the hippocampus: from neuronal and circuit mechanisms to behavior. Front Cell Neurosci 2021; 15:31 Crossref, Google Scholar
18.: First occurrence of hippocampal spatial firing in a new environment. Exp Neurol 1978; 62:282–297 Crossref, Google Scholar
19.: Theta burst stimulation is optimal for induction of LTP at both apical and basal dendritic synapses on hippocampal CA1 neurons. Brain Res 1992; 591:332–336 Crossref, Google Scholar
20.: The effect of short-duration bursts of high-frequency, low-intensity transcranial magnetic stimulation on the human motor cortex. Clin Neurophysiol 2004; 115:1069–1075 Crossref, Google Scholar
21.: Effectiveness of theta burst versus high-frequency repetitive transcranial magnetic stimulation in patients with depression (THREE-D): a randomised non-inferiority trial. Lancet 2018; 391:1683–1692 Crossref, Google Scholar
22.: Simple metric for scaling motor threshold based on scalp-cortex distance: application to studies using transcranial magnetic stimulation. J Neurophysiol 2005; 94:4520–4527 Crossref, Google Scholar
23.: Motor threshold in transcranial magnetic stimulation: a comparison of a neurophysiological method and a visualization of movement method. J ECT 1998; 14:25–27 Crossref, Google Scholar
24.: Determination of motor threshold using visual observation overestimates transcranial magnetic stimulation dosage: safety implications. Clin Neurophysiol 2014; 125:142–147 Crossref, Google Scholar
25.: Using the international 10-20 EEG system for positioning of transcranial magnetic stimulation. Brain Topogr 2003; 16:95–99 Crossref, Google Scholar
26.: Measuring and manipulating brain connectivity with resting state functional connectivity magnetic resonance imaging (fcMRI) and transcranial magnetic stimulation (TMS). Neuroimage 2012; 62:2232–2243 Crossref, Google Scholar
27.: Accelerated repetitive transcranial magnetic stimulation for treatment-resistant depression. Depress Anxiety 2010; 27:960–963 Crossref, Google Scholar
28.: Stanford Neuromodulation Therapy (SNT): a double-blind randomized controlled trial. Am J Psychiatry 2022; 179:132–141 Link, Google Scholar






دیدگاه خود را ثبت کنید
تمایل دارید در گفتگوها شرکت کنید؟در گفتگو ها شرکت کنید.