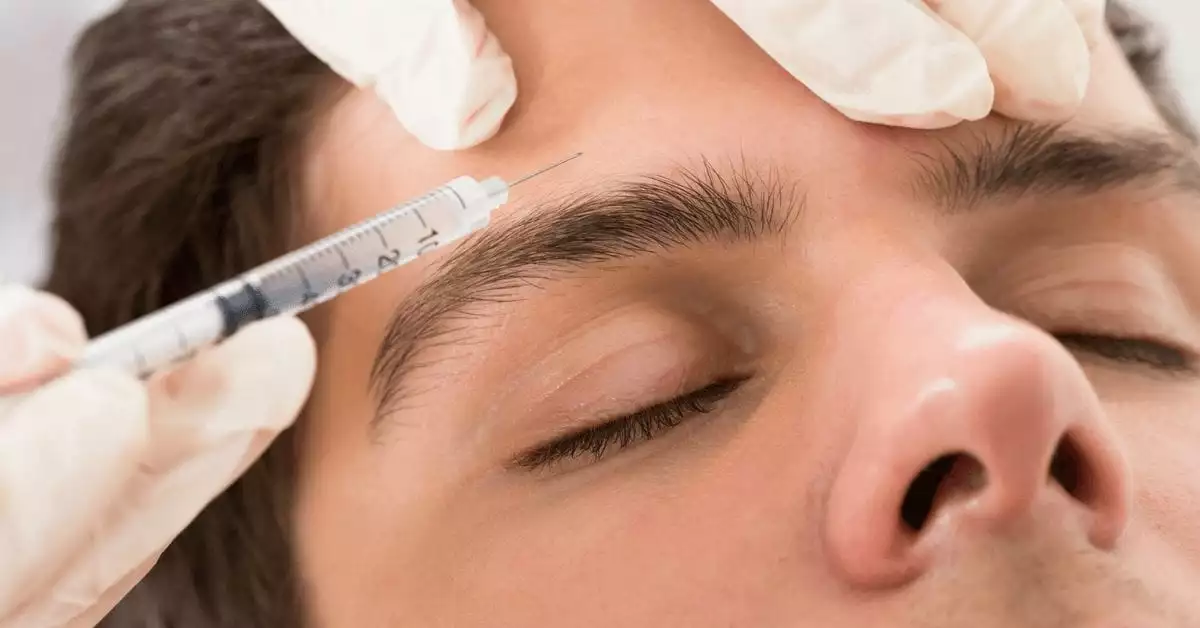
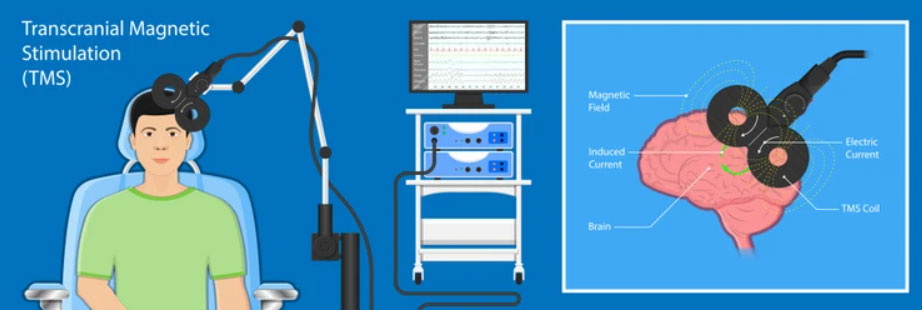
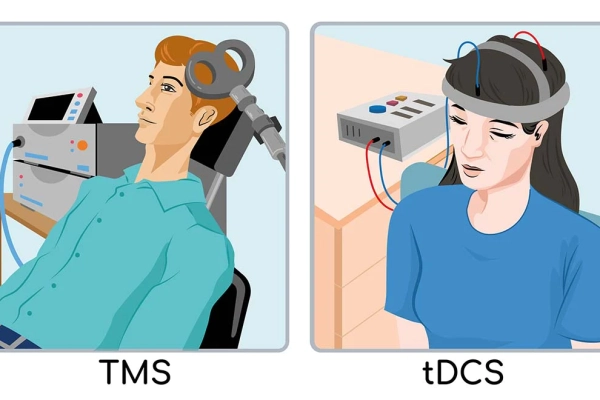
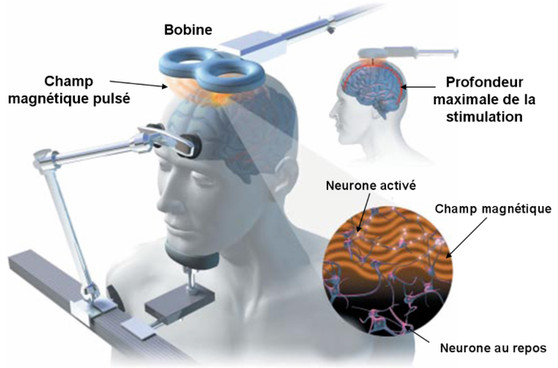
در این مقاله می خواهیم درباره تحریک مغناطیسی مغز rTMS درمان افسردگی و اختلالات مهاری، تاریخچه و جهت گیری های آینده آن بپردازیم.
توسعه تحریک مغناطیسی ترانس کرانیال (TMS) یک مثال گویا از اینکه چگونه یک وسعت از تخصص و فنآوری میتواند برای تغییر درمان افسردگی با هم ترکیب شود، ارائه میدهد.
الگوریتم های rTMS: تجزیه و تحلیل زیستی
کشف مایکل فارادی از القای الکترومغناطیسی در سال ۱۸۳۱ یک پیشرفت اساسی در فیزیک است که در نهایت TMS را تنها ۱۵۰ سال بعد فعال کرد.
کار پیشگام در الکترومغناطیس توسط مایکل فارادی و دانشجویانش جیمز کلرک ماکسول (که تصادفا در سال ۱۸۳۱ متولد شد)، فیزیکدانان و سپس فیزیولوژیستها را قادر ساخت تا اثرات الکتروشیمیایی میدان های مغناطیسی را مطالعه کنند (۱، ۲).
میدان های مغناطیسی پالسی برای اولین بار در سال ۱۹۶۵ نشان داده شدند که موجب ایجاد لرزش در ماهیچههای اسکلتی در مدلهای حیوانی و انسانها میشوند (۳).
دو دهه بعد، اولین دستگاهی که فعالیت قشر مغز را با استفاده از میدان مغناطیسی پالسی تولید کرد، توسط فیزیکدان پزشکی آنتونی بارکر و تیمش توسعه یافت (۴). این دستگاه TMS اول هر ۳ ثانیه یک پالس را تحویل میداد و نشان میداد که تحریک قشر حرکتی، حرکات سمت مقابل بدن را استخراج میکند.
در دهههای بعدی، بهبود در مهندسی کویلهای TMS، از جمله بهبود در پارامترهای پالس، فنآوری خنک سازی، و پیکربندی کویلهای دوگانه، کاربرد تبدیل پذیر این فنآوری را هم در تحقیقات نوروفیزیولوژی و هم در تحقیقات بالینی ممکن میسازد (۵).
این پیشرفتهای تکنولوژیکی طیف گستردهای از پارامترهای تحریک را برای بررسی، از جمله دوز تحریک، فرکانس، ریتم و هدف. TMS واکنشی (rTMS)تبدیل به تمرکز مداخله درمانی شد، زیرا نشان داده شد که rTMS یک افزایش پایدار یا کاهش در فعالیت کورتکس مرکزی ایجاد میکند.
این که rTMS افزایش یابد یا کاهش فعالیت کورتکس به پارامترهای پالس خاص مورد استفاده بستگی دارد (۶). تحریک “فرکانس بالا”، در محدوده ۵ Hz – ۲۰ Hz، به طور گستردهای برای افزایش فعالیت در منطقه تحریکشده قشر مغز در نظر گرفته شد.
rTMS درمان افسردگی
آغاز بالینی
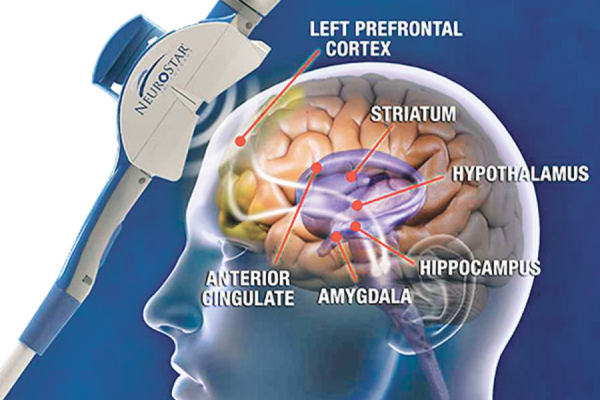
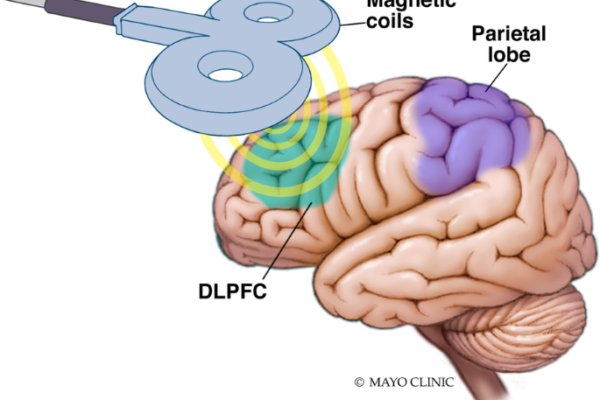
از اوایل دهه ۱۹۹۰، براساس مطالعات آسیب مغزی و مطالعات نوروایمپینگ کارکردی، اختلال عملکرد قشر پیش پیشانی پشتی – جانبی چپ (L – dlPFC)با افسردگی مرتبط بود. اندکی پس از آن، محققان rTMS بر L – dlPFC به عنوان یک سایت هدف در درمان اختلال افسردگی اساسی (همانطور که توسط DSM – I V در آن زمان تعریف شد)متمرکز شدند (۷، ۸).
این خط تحقیق منجر به مطالعه چند مکانی دو سویه کور توسط O ” Reardon et al. (۹)شد که به کار گیری در سال ۲۰۰۴ آغاز شد، که در آن بیمارانی که دارو درمانی برای اختلال افسردگی اساسی در آنها با شکست مواجه شده بود یا rTMS پرتکرار را در L – dlPFC یا درمان شم دریافت کرده بودند. rTMs به طور قابلتوجهی میزان پاسخ و بهبودی بیشتری را ایجاد کرد.
این مطالعه در سال ۲۰۰۷ منتشر شد، و در سال بعد، اداره غذا و دارو (FDA)اولین پروتکل rTMS را برای بیمارانی تصویب کرد که افسردگی آنها نتوانست به حداقل یک آزمایش کافی دارو درمانی پاسخ دهد (۱۰): جلسات درمان روزانه rTMS، پنج بار در هفته به مدت ۴ تا ۶ هفته، با پالسهای ۱۰ هرتز، برای مجموع ۳۰۰۰ پالس به L – PdlFC بیش از ۳۷.۵ دقیقه (۹، ۱۱).
rTMs در جایگاه ویژه : شناسایی بلند مدت
اگرچه کارایی بالینی rTMS اثبات شدهاست، مکانیسم دقیق که با آن rTMS منجر به تغییرات پایدار در فعالیت کورتیکال و تسکین علائم میشود هنوز به طور کامل تعریفنشده است. با این حال، تقویت طولانیمدت (LTP)فعالیت نورونی در مناطق کلیدی مغز، مظنون به ایفای نقش مرکزی است (۶، ۱۲). LTP برای بسیاری از اشکال یادگیری و حافظه بنیادی در نظر گرفته میشود و یکی از مکانیزمهای اصلی شکلپذیری سیناپسی است.
به طور خلاصه، LTP شامل بازده افزایشیافته پایدار انتقال سیگنال در طول سیناپسها در پاسخ به الگوهای خاص تحریک، مانند اشکال خاص rTMS است (۱۳). LTP از طریق تغییرات پیچیده در دستگاه مولکولی پیش و پس سیناپسی، از جمله گیرندههای سطحی سلول، آزاد سازی انتقالدهنده عصبی و سیتومعماری میانجی گری میشود (۱۳).
LTP این اصل را منعکس میکند که “سلولهایی که به هم شلیک میکنند، به هم متصل میشوند”، که از کتاب رویایی، سازمان رفتار (۱۹۴۹) اثر دونالد هب، به اصطلاح “پدر روانشناسی اعصاب” نقل شدهاست.
شواهد حمایت از وجود LTP اولین بار در اواسط دهه ۱۹۶۰ به تفصیل شرح داده شد (۱۴). در همین زمان، اریک کاندل، روانشناس برجسته، در حال پیشبرد مطالعه مولکولی شکلگیری حافظه، از جمله مطالعه LTP بود. دکتر کاندل ادامه میداد تا آن را به اشتراک بگذارد. جایزه نوبل فیزیولوژی یا پزشکی در سال ۲۰۰۰ برای این کار.
توصیف فرآیند دریافت نتایج تحقیق از آزمایشگاه به کلینیک : پشت سرهم
درک LTP بعدا امکان توسعه تحریک پشت سر هم تپنده، یک الگوی محرک کارامدتر برای LTP و به نوبه خود یک الگوی پالس rTMS کارامدتر را فراهم می کند. با این حال، ریشه های اصطلاح “theta” با توسعه الکتروانسفالوگرافی (EEG) اغاز شد.
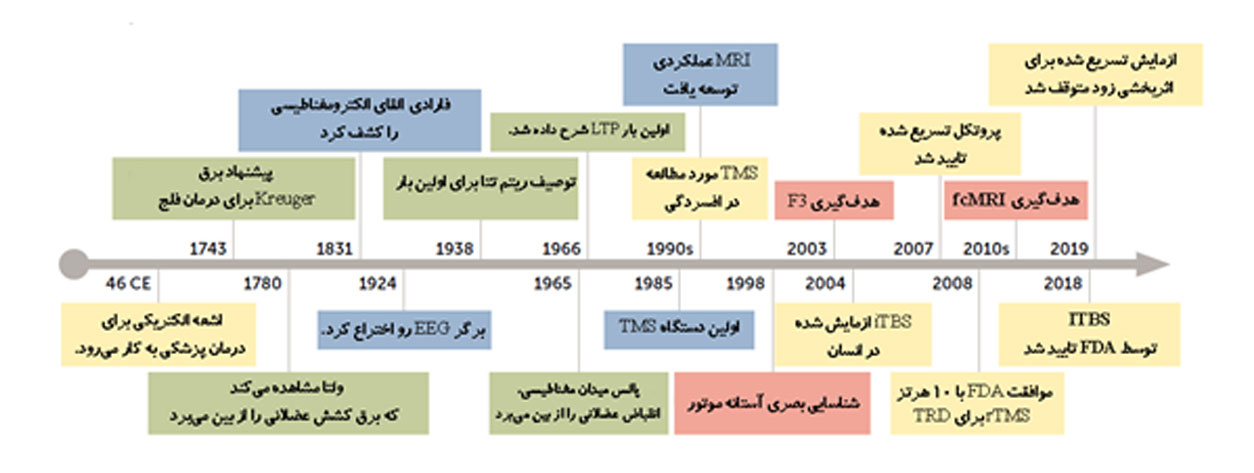
شکل1) پیشرفت های کلیدی در تاریخچه تحریک مغناطیسی ترانس کرانیال تکراری
در سال 1924، روانپزشک هانس برگر اولین EEG انسانی را ثبت کرد. دکتر برگر الگوهای موج مغزی را بر اساس محدوده فرکانس طبقه بندی کرد، و او به نام محدوده الفا (8 هرتز −13 هرتز) و محدوده بتا (13 هرتز −30 هرتز). نامگذاری با حروف یونانی به ترتیب کشف از سر گرفته می شود و محدوده اتا (4 هرتز تا 8 هرتز) دهه ها بعد شناسایی شد (16).
اگر چه EEG پوست سر اجازه مطالعه غیر تهاجمی فعالیت الکتریکی قشر انسان را می دهد، مطالعات نوروفیزیولوژیکی همزمان در مدل های حیوانی نیز انفجارهای قوی فعالیت نورونی هیپوکامپ را در محدوده فرکانس شبیه به طتا کشف کرد و بنابراین این ریتم های هیپوکامپ به طور مشابه نامگذاری شدند. اگر چه ارتباط بین ریتم های قشری و هیپوکامپ تا به طور کامل درک نشده است، تصور می شود که هیپوکامپ نقش مهمی در تولید ریتم های اتا در مناطق قشری گسترده دارد (17).
در دهه 1970، ضبط میکروالکترود in vivo از مغز موش نشان داد که نورون های هیپوکامپ در طول رفتار اکتشافی، پتانسیل های عمل را در فرکانس تنظیم می کنند(18).
این فرضیه ها را تحریک می کند در مورد نقش انفجارهای تاتا در یادگیری و حافظه، و در اوایل دهه 1990، نشان داده شد که LTP در سیناپس های هیپوکامپ با انفجار تحریک الکترود در فرکانس محدوده تا (19) تسهیل می شود.در حالی که O’Reardon و همکارانش (9) کارازمایی بالینی را رهبری می کردند که منجر به تایید اولیه FDA از rTMS برای درمان افسردگی شد، محققان rTMS که ازمایشات پیش بالینی الگوهای پالس rTMS را اغاز کردند، ریتم های تیتا درون زا را که در مغز پستانداران دیده می شود، مدل سازی کردند.
اولین مطالعه ازمایشی تحریک پشت سر هم تتا (TBS) با استفاده از rTMS در داوطلبان سالم در سال 2004 منتشر شد و نوید افزایش زیادی در تقویت کارایی rTMS را داد. پالایش اضافی به نفع TBS متناوب (iTBS) است – یعنی TBS با مکث بین قطارهای کوتاه تحریک.
تا سال 2013، استخدام برای یک کارازمایی تصادفی چند سایتی غیر تصادفی در کانادا اغاز شد، مقایسه iTBS با rTMS 10 هرتز معمولی بیش از L-dlPFC برای اختلال افسردگی اساسی مقاوم به درمان (21).
اگر چه iTBS یک پنجم از تعداد کل پالس ها را در کمتر از یک دهم زمان تحویل داد، نتایج منتشر شده در سال 2018 نشان داد که iTBS غیر قابل تحمل است، با تحمل مشابه. هر دو بازوی درمان 50٪ کاهش علائم در حدود 50٪ از بیماران و بهبودی در 30٪ به دست اورد. در همان سال، FDA پروتکل iTBS را برای اختلال افسردگی اساسی مقاوم در برابر درمان، با یک برنامه شبیه به پروتکل قبلی 10 هرتز، اما ارائه انفجار سریع پالس ها با نرخ 5 هرتز، در مجموع 600 پالس به L-dlPFC در بیش از 3 دقیقه.
شخصی سازی درمان: دوز و هدف
تفاوت های فردی در فاصله قشر پوست سر و قشر سیتوارکیتکچر بر پاسخ قشری به TMS تاثیر می گذارد (22). استانه موتور (MT) به عنوان یک مفهوم ظهور کرد که اجازه می دهد خروجی ماشین TMS شخصی سازی شود. MT حداقل “دوز” فردی خروجی ماشین TMS (به عنوان درصد حداکثر خروجی ان) مورد نیاز برای استخراج یک پاسخ موتور مخالف است.
در سال 1998، نشان داده شد که تجسم حرکات دست مقابل به طور موثر اندازه گیری الکترومیوگرافی MT را تقریبی می کند و این روش را حتی بیشتر ساده می کند (23). تعیین بصری MT همچنان یک روش به طور گسترده ای در کلینیک ها و تحقیقات TMS است، زیرا اجازه می دهد تا برای تعیین نسبتا سریع MT بدون استفاده از ابزارهای تشخیصی اضافی (مانند تشخیص الکترومیوگرافی MT یا EEG در مناطق قشر پیشانی هدف) (24). با این حال، مهم است که بدانیم استفاده ازMT شامل این فرض کلیدی است که استانه پاسخ سایر مناطق قشری مانند dlPFC به اندازه کافی شبیه استانه پاسخ قشر حرکتی است.
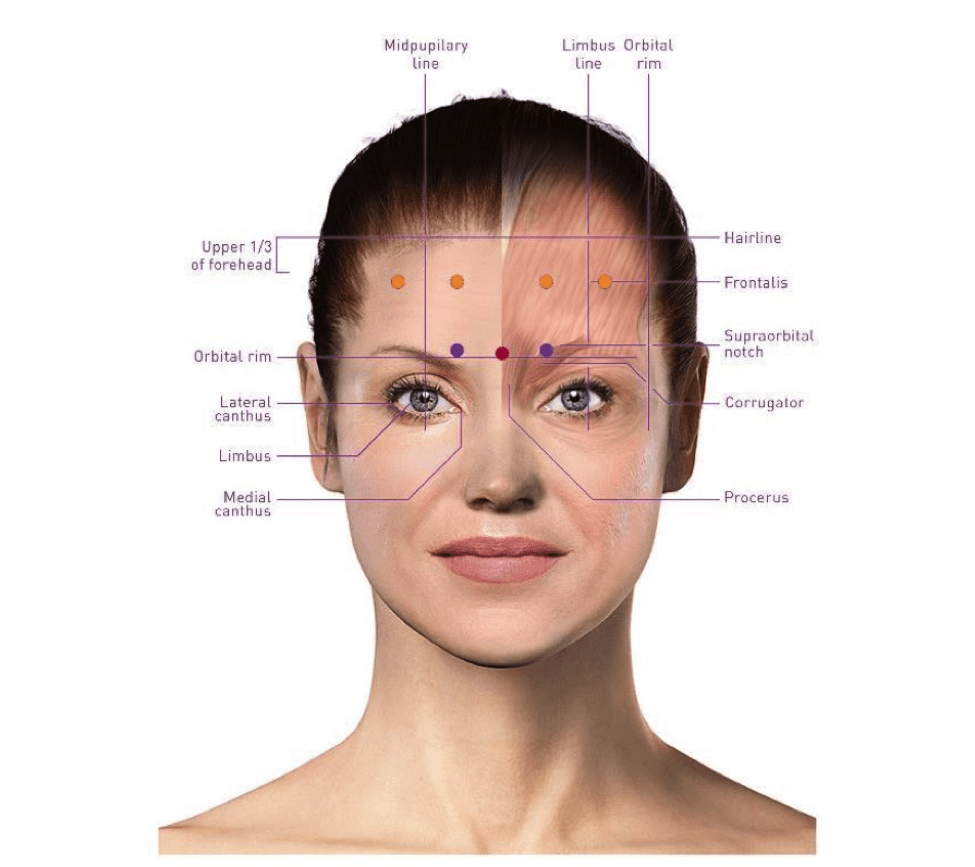
پروتکل مطالعه 2007 توسط O’Reardon و همکارانش (9) dlPFC را با استفاده از یک “قانون 5 سانتی متری” هدف قرار داد که در ان کویل 5 سانتی متر قدامی به محل تحریک قرار می گیرد که حرکات حرکتی را در انگشت شست راست ایجاد می کند. با این حال، تا سال 2003، قرار دادن الکترود EEG F3 در سیستم بین المللی 10-20 بود. شناسایی به عنوان یک روش قابل اعتماد تر برای هدف قرار دادن dlPFC (25).
اکتشاف بیشتر برای موقعیت سیم پیچ و بهبود در این سیستم به دنبال خواهد داشت. همانطور که انتظار می رود، هدف گیری هدایت شده با تصویربرداری عصبی پیشنهاد می شود، با پروتکل های تحقیقاتی شامل تکنیک های تصویربرداری ساختاری به سرعت راه را برای استفاده از تکنیک های تصویربرداری کاربردی. در اوایل دهه 2010، مطالعات rTMS شروع به استفاده از MRI اتصال عملکردی (fcMRI)، یک تصویربرداری عصبی عملکردی کرد.
تکنیکی که ارتباط فعالیت بین مناطق مختلف مغز را اندازه گیری می کند و امکان نقشه برداری شبکه های عصبی را می دهد. مطالعات fcMRIپیشنهاد کرد که تحریک منطقه خاصی از dlPFC است که بیشتر anticorrelated با فعالیت در subgenual قشر کمربند قدامی، منطقه ای که قبلا به عنوان بیش فعالی در افسردگی دخیل بود، ممکن است میزان پاسخ درمان را بهینه تر کند( 26).
تحولات معاصر و مسیرهای آینده در زمینه rTMS درمان افسردگی و اختلالات مهاری
پروتکل های TMS تسریع شده با پنج جلسه تنی در یک روز در اوایل سال 2010 موفق بودند و کارایی سریع بهبود یافته iTBS تا حد زیادی برنامه های درمانی تسریع شده را تسهیل کرد. تا سال 2017، استخدام برای یک کارازمایی تصادفی shamcontrolled تصادفی دو سویه کور اغاز شد که یک دوره تسریع شده از جلسات درمان 50 را فقط در طول 5 روز با هدف قرار دادن فردی هدایت شده توسط fcMRI (28) ترکیب کرد.
علاوه بر این، هر یک از جلسات درمانی به مدت ۱۰ دقیقه به جای ۳ دقیقه اجرا شدند، که در مجموع ۹۰۰۰۰ پالس تنها در ۵ روز تحویل داده شد. در یک تحلیل موقت برنامهریزیشده، آزمایش برای اثر متوقف شد: ۵۰ % کاهش علائم و بهبودی به ترتیب در ۷۱ % و ۵۷ % از شرکت کنندگان در بازوی درمان، در مقایسه با ۱۳ % و ۰ % از کسانی که در گروه کنترل بودند، حاصل شد. اگر چه یک روند غیر معنیدار برای عود علائم در طول ۴ هفته پیگیری مشاهده شد، یک کاهش ۵۰ درصدی علائم میزان بهبودی در گروه درمان ۶۴ % و در گروه کنترل ۴۳ % بود.
چنین برنامههای تسریع شده به ویژه برای مطالعات آینده در محیطهای بستری و جایی که درمان سریع افسردگی برای مدیریت حاد خودکشی مورد نیاز است، جذاب هستند.
از سوی دیگر، بیشتر آزمایشها تا کنون بر روی دوره شاخص درمان تمرکز کردهاند و پیگیری محدودی داشتهاند. تحقیقات و توسعه آینده نیز به احتمال زیاد به تعیین نقش برای درمان تعمیر و نگهداری تبدیل خواهد شد. در حالی که درمان تشنجی به طور کلی برای شدیدترین موارد افسردگی حفظ شدهاست، در دسترس بودن و اثربخشی rTMS ممکن است آن را به عنوان یک مکمل مهم برای رواندرمانی و دارو درمانی در درمان افسردگی قرار دهد.
تاریخ توسعه rTMS، از نظریههای بنیادی گرفته تا آخرین پروتکلهای iTBS تسریع شده و شخصی شده (که در شکل ۱ خلاصه شدهاست)، یادآور الهامبخش این موضوع است که چگونه پیشرفتهای میان رشتهای تدریجی میتوانند با هم جمع شوند تا جهش در درمان پزشکی ایجاد کنند.
این مسیر همچنین بر اهمیت سرمایهگذاری روانپزشکان در طیف کامل تحقیقات ترجمهای، از علم کرسی و توسعه فنآوری تا آزمایشها بالینی و بازگشت تاکید میکند.
منابع
https://ajp.psychiatryonline.org/doi/10.1176/appi.ajp-rj.2023.180304
1.Fitzgerald PB, Daskalakis ZJ: Repetitive Transcranial Magnetic Stimulation Treatment for Depressive Disorders. Berlin, Springer, 2013 Crossref, Google Scholar
2.McWhirter L, Carson A, Stone J: The body electric: a long view of electrical therapy for functional neurological disorders. Brain 2015; 138:1113–1120 Crossref, Google Scholar
3.Walsh V, Pascual-Leone A, Kosslyn SM: Transcranial Magnetic Stimulation: A Neurochronometrics of Mind. Cambridge, MA, MIT Press, 2003 Google Scholar
4.Barker AT, Jalinous R, Freeston IL: Non-invasive magnetic stimulation of human motor cortex. Lancet 1985; 325:1106–1107 Crossref, Google Scholar
5.Goetz SM, Deng Z-D: The development and modelling of devices and paradigms for transcranial magnetic stimulation. Int Rev Psychiatry 2017; 29:115–145 Crossref, Google Scholar
6.Klomjai W, Katz R, Lackmy-Vallée A: Basic principles of transcranial magnetic stimulation (TMS) and repetitive TMS (rTMS). Ann Phys Rehabil Med 2015; 58:208–213 Crossref, Google Scholar
7.George MS, Wassermann EM, Williams WA, et al.: Daily repetitive transcranial magnetic stimulation (rTMS) improves mood in depression. Neuroreport 1995; 6:1853–1856 Crossref, Google Scholar
8.Pascual-Leone A, Rubio B, Pallardó F, et al.: Rapid-rate transcranial magnetic stimulation of left dorsolateral prefrontal cortex in drug-resistant depression. Lancet 1996; 348:233–237 Crossref, Google Scholar
9.O’Reardon JP, Solvason HB, Janicak PG, et al.: Efficacy and safety of transcranial magnetic stimulation in the acute treatment of major depression: a multisite randomized controlled trial. Biol Psychiatry 2007; 62:1208–1216 Crossref, Google Scholar
10.Cohen SL, Bikson M, Badran BW, et al.: A visual and narrative timeline of US FDA milestones for transcranial magnetic stimulation (TMS) devices. Brain Stimul 2022; 15:73–75 Crossref, Google Scholar
11.Yan J: FDA approves new option to treat major depression. Psychiatr News 2008; 43:2–17 Crossref, Google Scholar
12.Chervyakov AV, Chernyavsky AY, Sinitsyn DO, et al.: Possible mechanisms underlying the therapeutic effects of transcranial magnetic stimulation. Front Hum Neurosci 2015; 9:303 Crossref, Google Scholar
13.Hayashi Y: Molecular mechanism of hippocampal long-term potentiation: towards multiscale understanding of learning and memory. Neurosci Res 2022; 175:3–15 Crossref, Google Scholar
14.Lømo T: The discovery of long-term potentiation. Philos Trans R Soc B Biol Sci 2003; 358:617–620 Crossref, Google Scholar
15.Haas LF: Hans Berger (1873–1941), Richard Caton (1842–1926), and electroencephalography. J Neurol Neurosurg Psychiatry 2003; 74:9 Crossref, Google Scholar
16.Ray WJ, Slobounov S: Fundamentals of EEG methodology in concussion research; in Foundations of Sports-Related Brain Injuries. Edited by Slobounov S, W Sebastianelli. Berlin, Springer, 2006 Crossref, Google Scholar
17.Nuñez A, Buño W: The theta rhythm of the hippocampus: from neuronal and circuit mechanisms to behavior. Front Cell Neurosci 2021; 15:31 Crossref, Google Scholar
18.Hill AJ: First occurrence of hippocampal spatial firing in a new environment. Exp Neurol 1978; 62:282–297 Crossref, Google Scholar
19.Capocchi G, Zampolini M, Larson J: Theta burst stimulation is optimal for induction of LTP at both apical and basal dendritic synapses on hippocampal CA1 neurons. Brain Res 1992; 591:332–336 Crossref, Google Scholar
20.Huang Y-Z, Rothwell JC: The effect of short-duration bursts of high-frequency, low-intensity transcranial magnetic stimulation on the human motor cortex. Clin Neurophysiol 2004; 115:1069–1075 Crossref, Google Scholar
21.Blumberger DM, Vila-Rodriguez F, Thorpe KE, et al.: Effectiveness of theta burst versus high-frequency repetitive transcranial magnetic stimulation in patients with depression (THREE-D): a randomised non-inferiority trial. Lancet 2018; 391:1683–1692 Crossref, Google Scholar
22.Stokes MG, Chambers CD, Gould IC, et al.: Simple metric for scaling motor threshold based on scalp-cortex distance: application to studies using transcranial magnetic stimulation. J Neurophysiol 2005; 94:4520–4527 Crossref, Google Scholar
23.Pridmore S, Fernandes Filho JA, Nahas Z, et al.: Motor threshold in transcranial magnetic stimulation: a comparison of a neurophysiological method and a visualization of movement method. J ECT 1998; 14:25–27 Crossref, Google Scholar
24.Westin GG, Bassi BD, Lisanby SH, et al.: Determination of motor threshold using visual observation overestimates transcranial magnetic stimulation dosage: safety implications. Clin Neurophysiol 2014; 125:142–147 Crossref, Google Scholar
25.Herwig U, Satrapi P, Schönfeldt-Lecuona C: Using the international 10-20 EEG system for positioning of transcranial magnetic stimulation. Brain Topogr 2003; 16:95–99 Crossref, Google Scholar
26.Fox MD, Halko MA, Eldaief MC, et al.: Measuring and manipulating brain connectivity with resting state functional connectivity magnetic resonance imaging (fcMRI) and transcranial magnetic stimulation (TMS). Neuroimage 2012; 62:2232–2243 Crossref, Google Scholar
27.Holtzheimer PE, McDonald WM, Mufti M, et al.: Accelerated repetitive transcranial magnetic stimulation for treatment-resistant depression. Depress Anxiety 2010; 27:960–963 Crossref, Google Scholar
28.Cole EJ, Phillips AL, Bentzley BS, et al.: Stanford Neuromodulation Therapy (SNT): a double-blind randomized controlled trial. Am J Psychiatry 2022; 179:132–141 Link, Google Scholar